Где ИИ в радиологии развит лучше - в России или в мире?
Где ИИ в радиологии развит лучше - в России или в мире?
Недавно вышла толстенькая монография “Искусственный интеллект в лучевой диагностике: Per Aspera Ad Astra”, которая описывает результаты Московского Эксперимента с 2020 по 2025 годы. Путь проделан реально огромный - я часто говорю, что по моему субъективному ощущению Россия сейчас минимум в топ-3 по использованию ИИ в радиологии. Так ли это? Я решил изучить статьи, описывающие разработку и внедрение ИИ по всему миру, брал статьи за 2024-2025 год, чтоб отразить более-менее свежий опыт - такие штуки устаревают быстро. В итоге выбрал для обзора несколько штук, которые мне показались мне интереснее.
Сначала напишу про монографию и несколько отобранных мной статей, а в конце подведу итоги - есть ли разница в том, как внедряется ИИ в России и в мире?
Искусственный интеллект в лучевой диагностике: Per Aspera Ad Astra
Начнём непосредственно с виновника торжества. Такого объёма и деталей в описании внедрения ИИ в радиологию вы не найдёте нигде. Тут и история создания Эксперимента, и список всех сервисов с метриками, которые когда-либо принимали в нём участие. Но самое, на мой взгляд, интересное - это описание тех сценариев применения, что уже применяются и даже с каким-то экономическим эффектом, причём для каждой модальности и патологии указываются наиболее эффективные сценарии:
- Автоматизированная морфометрия - автоматическая сегментация и измерение различных показателей. В основном это касается 3D-исследований, на описание которых в некоторых случаях может уходить до 30 минут. Кроме экономии времени, некоторые измерения модели просто делают точнее, чем врачи на глаз (например, объёмы поражений органов).
- СППВР - или по-айтишному “копайлот”. Помощник врача, который позволяет обратить внимание на какие-то патологии, которые врач мог пропустить. Такая схема может быть реализована по-разному - например, можно всегда показывать результаты обработки или только тогда, когда между отчётом врача и ИИ есть клинически значимые расхождения (“safety net”).
- Автоматизированный оппортунистический скрининг - например, пациента направляют на КТ в рамках скрининга рака лёгких или по поводу сложной пневмонии. Врач в таком случае сосредоточится на решении именно этой клинической задачи, а вот ИИ-системе без разницы, она всегда распознаёт все патологии, которые обучена распознавать.
- Замена второго чтения - при интерпретации маммографических исследований в России и во многих других странах требуется анализ исследования двумя врачами. Замена одного из врачей на ИИ позволяет значительно сократить затраты времени, и при этом качество скрининга не падает.
- Автономная сортировка - для исследований с большой долей нормы (например, скрининговая флюорография) ИИ-системы могут автоматически отправлять в норму большую часть потока, не теряя в чувствительности. Исследования с нормой можно вообще не давать врачам или снижать их приоритет в рабочем списке.
Все эти сценарии в большей или меньшей степени были протестированы в рамках Эксперимента, системы ОМС в Москве и даже на уровне страны на платформе МосМедИИ. Хотя, насколько я понимаю, результаты обработки исследований на платформе в основном используются врачами только по первым двум сценариям (и то они не всегда пока вовремя видят результаты). Более хитрые, но экономически выгодные штуки требуют более тесной интеграции платформы с РИСами и PACSами. Со стороны кажется, что сейчас основной упор делается на масштаб - обрабатывать как можно больше исследований с наибольшего количества регионов. Своя логика в этом есть, но в будущем будет здорово увидеть и более кастомизированные интеграции, чтобы решать конкретные клинические задачи разных учреждений и регионов.
A holistic approach to implementing artificial intelligence in radiology
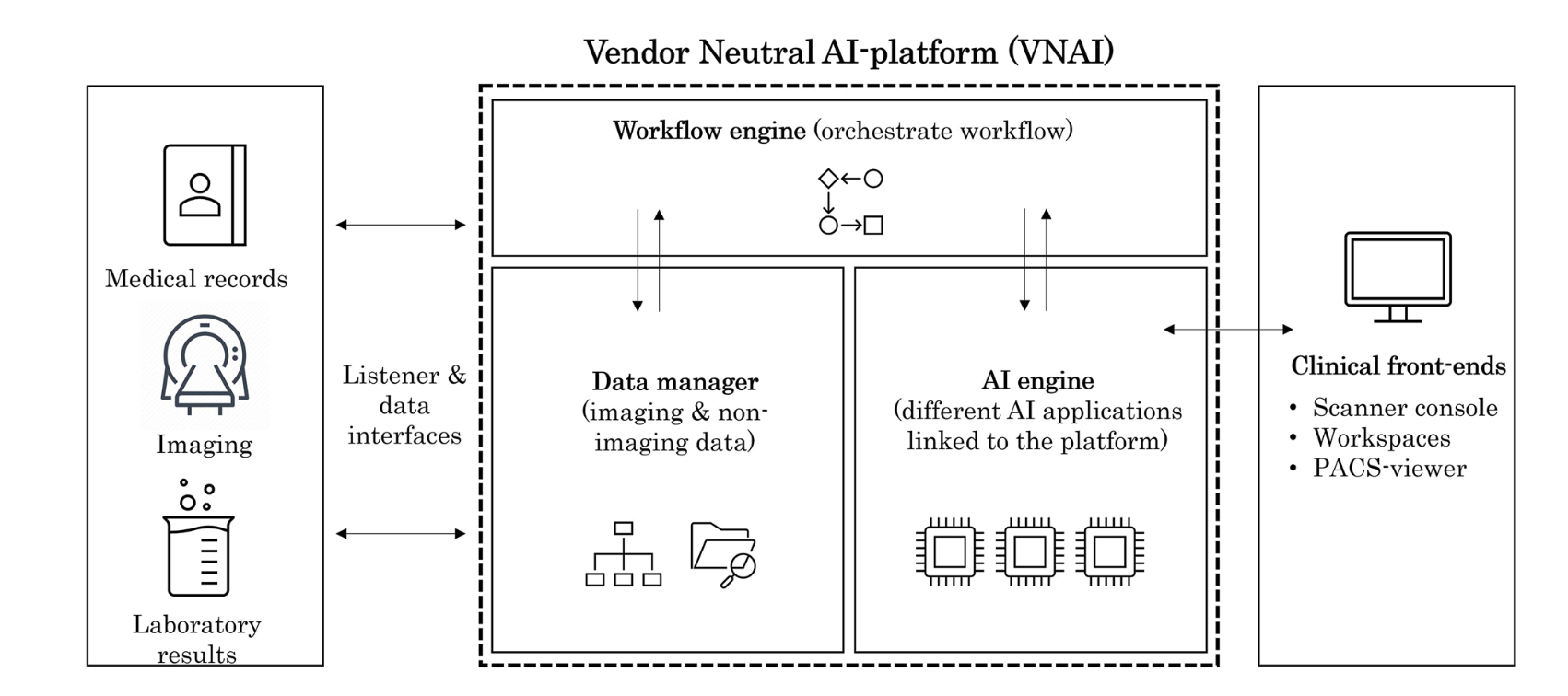 ИИ-платформа в клинике в Нидерландах
ИИ-платформа в клинике в Нидерландах
В большинстве стран государственные органы здравоохранения не занимаются непосредственно внедрением ИИ, а лишь оказывают посильную поддержку - разрабатывают гайдлайны, ведут реестры, занимаются обучением, выдают гранты. Поэтому медицинские учреждения сами должны решать проблемы интеграции с разными ИИ-сервисами от кучи вендоров. Один из вариантов - работа через специализированные платформы типа CARPL.ai.
В этой же статье описывается довольно необычный кейс - конкретный нидерландский медицинский центр, пусть и крупный, построил собственную ИИ-платформу - а-ля МосМедИИ в миниатюре. Эта платформа решает сразу ряд вопросов:
- Упрощает и ускоряет интеграцию с разными ИИ-вендорами - вряд ли у какой-то компании есть все нужные модальности и патологии.
- Осуществляет маршрутизацию исследований в нужную ИИ-систему (или несколько систем).
- Унифицирует процесс визуализации результатов работы ИИ-сервисов врачам.
Помимо технического уровня они произвели и организационные изменения:
- Создали внутреннюю Imaging Processing Group , в которую вошли рентген-лаборанты и technical physicians (новая профессия на стыке медицины и инженерии, внедряют всякие новые технологии и устройства в медицину; как я понял, это именно нидерландское ноу-хау). На них лежит много задач - стандартизация использования новых технологий (включая ИИ), оценка качества ИИ-алгоритмов, сбор фидбека и формирование списка необходимых фичей (например, возможность редактировать результаты работы ИИ-сервиса).
- Создали Clinical AI Implementation Group. Их работа начинается ещё до внедрения - они собирают заявки от врачей на кейсы использования ИИ, оценивают необходимость и ценность использования ИИ для решения каждой задачи. Ещё они создают материалы по правильному использованию ИИ, проводят обучение и выбирают в каждом подразделении “ИИ-чемпиона”, который собирает идеи от своих коллег.
В общем и целом всё это напоминает Эксперимент и МосМедИИ, но в масштабе одной медицинской организации. Из интересного для меня - Imaging Processing Group. Было бы здорово, если бы была возможность прямой коммуникации со специалистами, которые больше разбираются непосредственно в техническом процессе - как настраивается оборудование, как проставляются теги, какие дефекты могут появляться у оборудования со временем. Сейчас, к сожалению, такая коммуникация фактически отсутствует - такое возможно разве что при работе в коммерческих клиниках, и то не всегда.
How do medical institutions co-create artificial intelligence solutions with commercial startups?
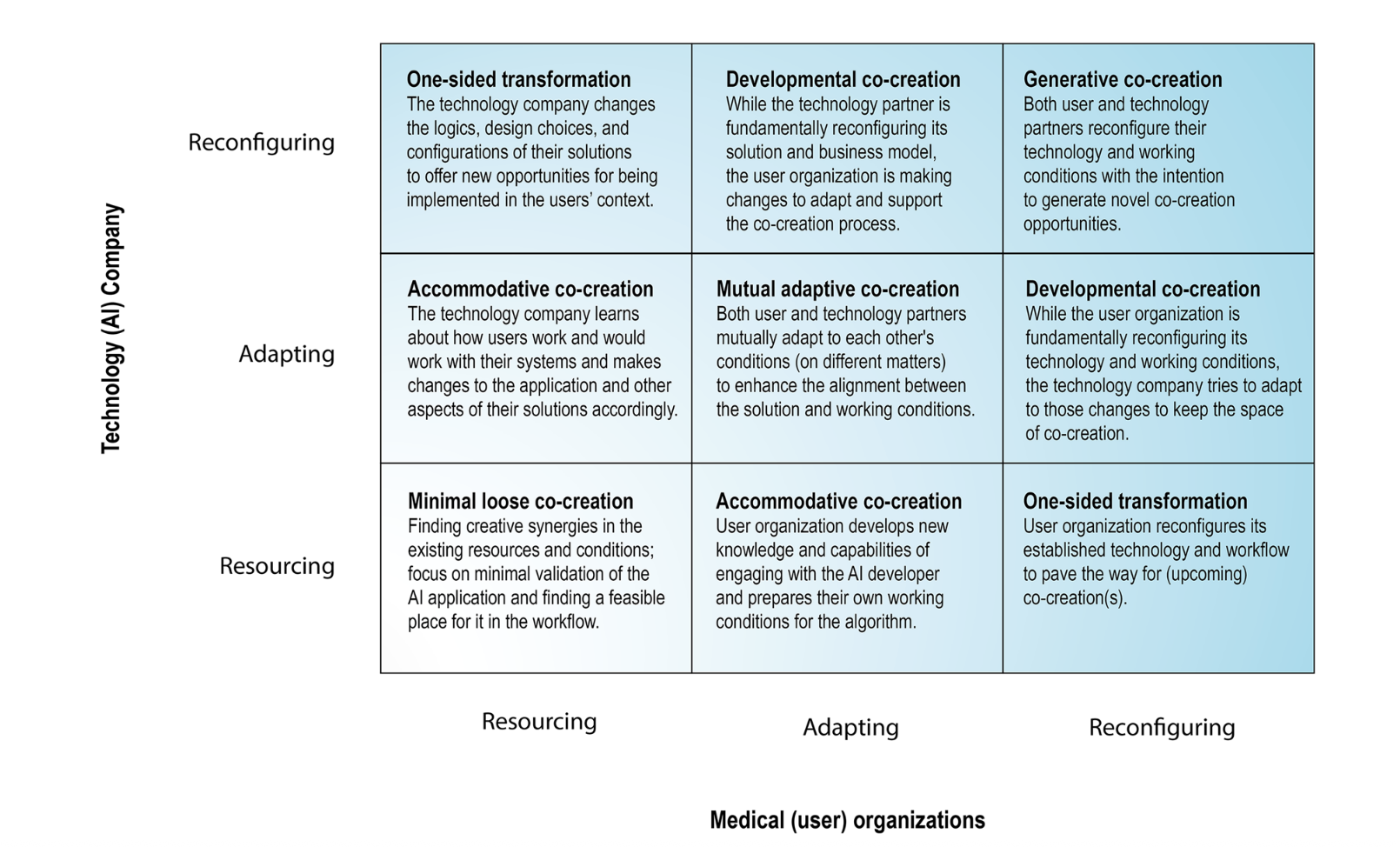 Матрица возможных вариантов взаимодействия между клиникой и ИИ-стартапом
Матрица возможных вариантов взаимодействия между клиникой и ИИ-стартапом
Разбирается три кейса совместного создания и внедрения ИИ-систем между медицинской организацией и ИИ-стартапами, тоже в Нидерландах. На их основе авторы предлагают фреймворк, в котором каждая сторона может быть вовлечена тремя способами:
- Resourcing - предоставление каких-либо ресурсов. Это могут быть данные, экспертиза в медицине или ИИ, вычислительные мощности, деньги. К примеру, больница выгружает данные по запросу стартапа, а тот сам обучает модель. Обмен обратной связью происходит не очень часто - скажем, раз в месяц. Это наимнее инвазивный подход, каждой компании не надо менять внутренние процессы и стратегию, не требуется какого-то предварительного налаживания доверия и коммуникации. Минусы тоже понятные - более поверхностное взаимодействие уменьшает потенциальную клиническую ценность продукта и его удобство для врачей. Да и вообще проект может умереть, если кто-то из партнёров внезапно решил поменять стратегию (так случилось в разбираемом кейсе).
- Adapting - одна из или обе стороны адаптируются под другую по мере создания продукта. В таком сценарии предполагается более частое общение между сторонами. К примеру, по результатам пилота может выясниться, что ценность принесёт совсем другой сценарий использования продукта, и ИИ-стартапу придётся дорабатывать свою систему, а медицинской организации - менять бизнес-процессы (например, принципы маршрутизации исследований). Такой подход позволяет создавать более полезные продукты, быстрее получать обратную связь, перенимать друг у друга экспертизу и даже изменять саму суть сервиса. Однако, это требует большего вовлечения сторон - больше времени на встречи, создание выделенных команд.
- Reconfiguration - стороны идут на кардинальные изменения. Меняется IT-архитектура, процессы, стратегия продукта, могут создаваться новые роли. Например, в рамках проекта клиника может перераспределить часть задач от врача-рентгенолога к рентген-лаборанту или перейти с локального PACS на облачный, а ИИ-стартап регулярно добавлять новые фичи, исходя из фидбека медицинской организации. В таком случае ИИ становится почти невидимой частью цифровой экосистемы больницы, но такие проекты требуют больших вложений времени, денег, а также создают сильную взаимную зависимость между партнёрами.
Естественно, в зависимости от размера компаний и других факторов могут встречаться разные сочетания - например, молодой стартап может пытаться сделать продукт чисто под большую клинику, которая при этом сама готова на данном этапе выделять только какие-то ограниченные ресурсы. По ходу развития проект может переходить из одного квадрата матрицы в другой - например, если есть первые успехи, партнёры могут решиться на более тесное взаимодействие и интеграцию.
По нашему опыту в России медорганизации регулярно обращаются с различными предложениями по поводу совместного создания продуктов, но такие идеи чаще всего разбиваются об один из двух факторов - либо слабые коммерческие перспективы проекта для ИИ-стартапа, либо как раз недостаточная готовность к вовлечению и взаимодействию со стороны медицинской организации.
Integration and ROI of AI Technology in Healthcare (AI Sweden)
Достаточно подробное описание болей внедрения ИИ в Швеции в формате white paper. Сначала автор перечисляет основные проблемы на примере реальных кейсов:
- Одной из главных проблем является сложность и длительность процесса закупки. К моменту, когда наконец пройдены все юридические и этические препоны, модель часто уже устаревает, а обязательства обновляться в контрактах обычно нет.
- В разных регионах процесс закупки может отличаться. К примеру, в Стокгольме требуют обоснование экономического эффекта (ROI) , а в других регионах - не всегда. Да и после внедрения редко трекается, удалось ли достичь заявленного эффекта.
- Недостаток компетенций в сферах ИИ и экономики здравоохранения затрудняет процесс сравнения разных поставщиков и построение бизнес-кейсов для закупки.
- ИИ-проекты часто предъявляют непривычные требования к IT-инфраструктуре медицинской организации - нужно делать выбор между локальным и облачным деплоем, менять принципы хранения данных или обновлять инфраструктуру, решать вопросы кибербеза и масштабируемости.
Следующая часть посвящена разным кейсам использования ИИ в медицине. Мне понравилось представление разных проектов на таком двухмерном графике (оси Driver и Level of innovation) с четырьмя зонами.
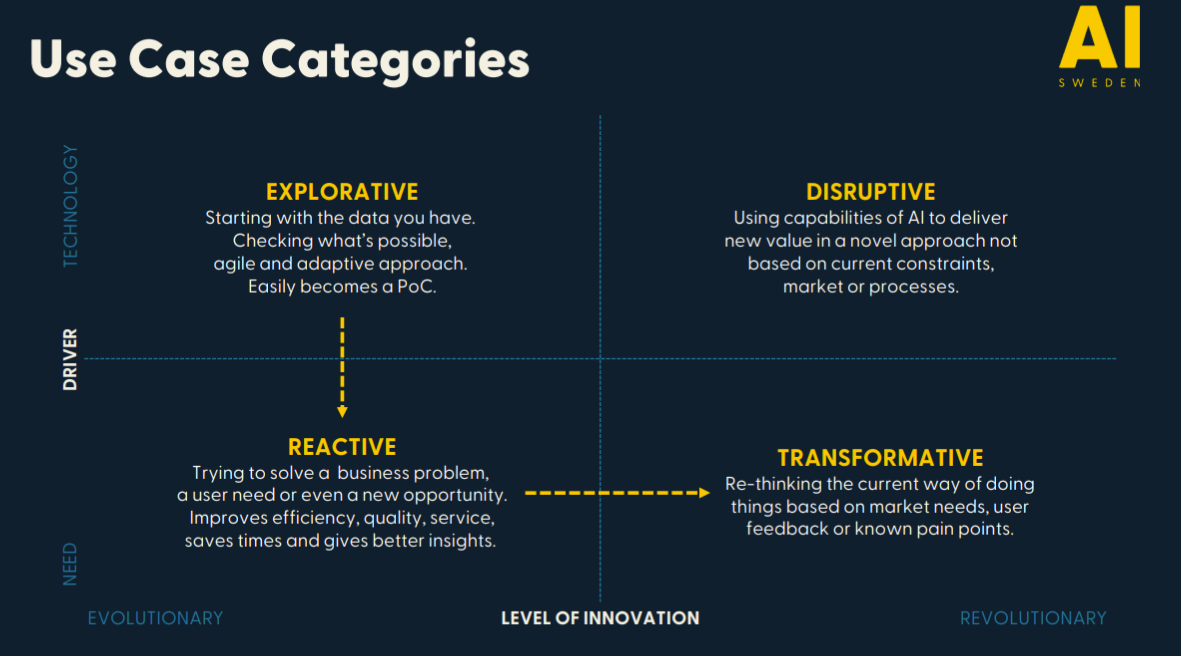 Матрица кейсов использования ИИ в медицине
Матрица кейсов использования ИИ в медицине
- Explorative - смотрим, что мы вообще можем сделать с имеющимися данными, делаем, пробуем внедрить. Примерно так начинался в том числе и Цельс - попытка найти важную клиническую задачу была, но во многом отталкивались и от технической возможности быстрого создания MVP.
- Reactive - смотрим, какие уже сейчас существуют бизнес-проблемы в медицинских организациях и пытаемся их решить. В первую очередь сюда относится всякая рутина, на которую уходит много времени. Многие новые проекты у нас в основном стартуют как раз таким образом.
- Transformative - смотрим на то, как устроены процессы, и пробуем их кардинально поменять. Например, заменяем второго врача в скрининге маммографии на ИИ-систему или автоматически описываем норму в флюорографии.
- Disruptive - полностью переворачиваем правила игры без оглядки на текущие процессы или ограничения. С ходу сложно назвать пример такого проекта. Может быть, когда кто-то сделает медицинский персонализированный ChatGPT?
Медицинским организациям рекомендуется по возможности строить диверсифицированное портфолио ИИ-проектов - включать и низкорисковые, и амбициозные проекты, покрывать разные области - не только самую развитую в плане технологий диагностику заболеваний.
Наконец, приведены шаги построения бизнес-кейса для обоснования необходимости закупки или старта внутреннего проекта.
- Выбираем конкретный кейс применения - лучше идти в глубину, слишком широкий фокус размоет анализ и не позволит сделать конкретные выводы.
- Определяем бейзлайн - если не описать, с чем будем производить сравнение, то и определить итоговый экономический эффект будет невозможно.
- Определяем методику сравнения - прямые сравнения метрик “врач vs ИИ” обычно имеют мало смысла. ИИ может быть хуже среднего врача, но при правильном использовании экономить время. Или наоборот - метрики будут высокие, но реального эффекта мы не увидим.
- Оцениваем внутренние ресурсы - хватит ли у организации компетенций, денег, времени для реализации проекта? Нужно ли привлекать внешних подрядчиков?
- Определяем потенциальные изменения поведения - как врачи или другой персонал будут взаимодействовать с ИИ-системой? Требуется ли для эффективного использования изменение текущего поведения? Какие организационные барьеры могут возникнуть при внедрении?
- ROI-анализ - с учётом всех предыдущих пунктов рассчитываем потенциальный экономический эффект в разных сценариях. Какие нужны будут затраты? Не забываем, что часто потребуется не только закупка или разработка ИИ-решения, но и серьёзное изменение внутренних процессов.
При этом автор призывает не забывать, что не стоит подходить к ИИ-проектам в медицине исключительно с узкой инвестиционной точки зрения. Существуют spillover-эффекты на уровне больницы или целого региона - например, первопроходец может потратить на реализацию проекта больше, чем в итоге получит, но другие отделы или больницы смогут воспользоваться плодами труда.
Artificial intelligence-assisted clinician review of chest X-rays for suspected lung cancer (Healthcare Improvement Scotland)
В шотландском регионе Грампиан решили оценить эффекты от использования ИИ-системы по анализу рентгенов лёгких от компании Annalise.
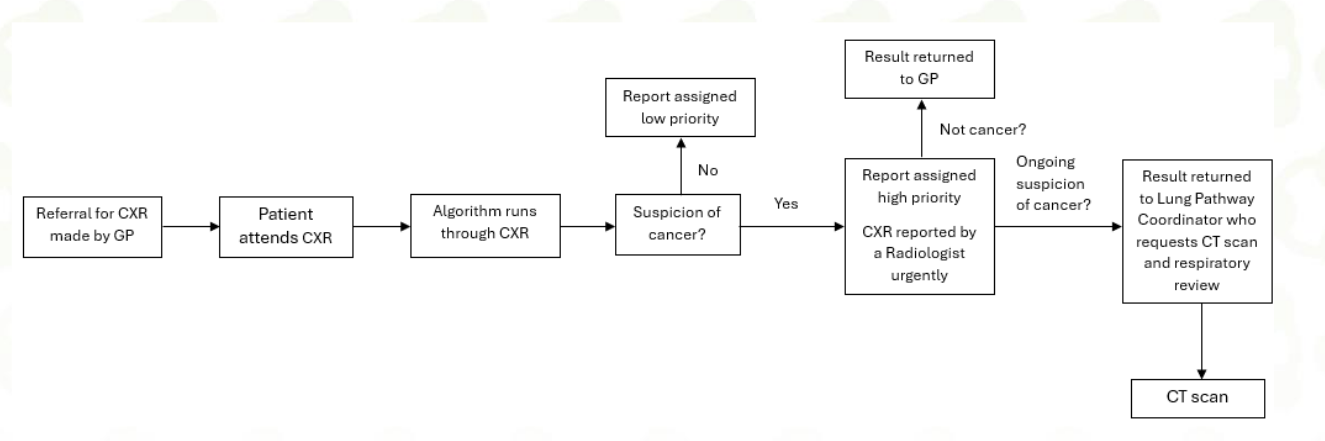 Бизнес-процесс после внедрения ИИ
Бизнес-процесс после внедрения ИИ
- Если алгоритм сигнализирует, что в исследовании есть признаки рака лёгких, то врачи смотрят такие исследования в первую очередь.
- Если подозрение ИИ подтверждается врачом, то пациент отправляется на срочное КТ-исследование.
- Из интересного - порог срабатывания системы был подобран таким образом, чтобы врачи вообще успевали оперативно интерпретировать исследования, помеченные как содержащие патологию.
- Далее специальный координатор связывался с пациентом для назначения КТ, а врач, читающий КТ-исследования, в первую очередь смотрел именно на эти исследования.
- Под эти КТ-исследования были зарезервированы специальные слоты.
В общем, не просто внедрили ИИ для галочки, а выстроили под систему специальный процесс, респект. Что по результатам?
- Количество дней от рентгена до КТ сократилось на 6 дней , а количество дней до начала лечения - на 7, что теоретически хорошо для пациентов.
- При этом на внедрение такой системы потратили дополнительно 274 тысячи фунтов в год или 3.59 фунта на пациента - деньги ушли на закупку ИИ и на выделение дополнительного персонала (координатор, время врачей). В шведской статье рекомендовали смотреть не только на стоимость закупки ИИ-сервиса - и правда, затраты на сам ИИ тут составили всего лишь четверть всех дополнительных расходов.
На бумаге экономически всё выглядит не очень хорошо, но при этом тут не учтен потенциальный долгосрочный выигрыш - экономия на химиотерапии, операциях, госпитализациях, рост выживаемости. К сожалению, такие эффекты посчитать очень сложно, да и самой медицинской организации в общем-то, как это ни меркантильно звучит, выгодно делать больше исследований и лечить больше людей. Так что внедрение таких сценариев использования ИИ, судя по всему, должно быть централизованным на уровне государства или региона.
Towards Clinically Useful AI: From Radiology Practices in Global South and North to Visions of AI Support
На основе интервью и наблюдений в двух очень разных странах - Дании и Кении, авторы делают выводы об областях, где использование ИИ могло бы быть клинически эффективно и оправдано.
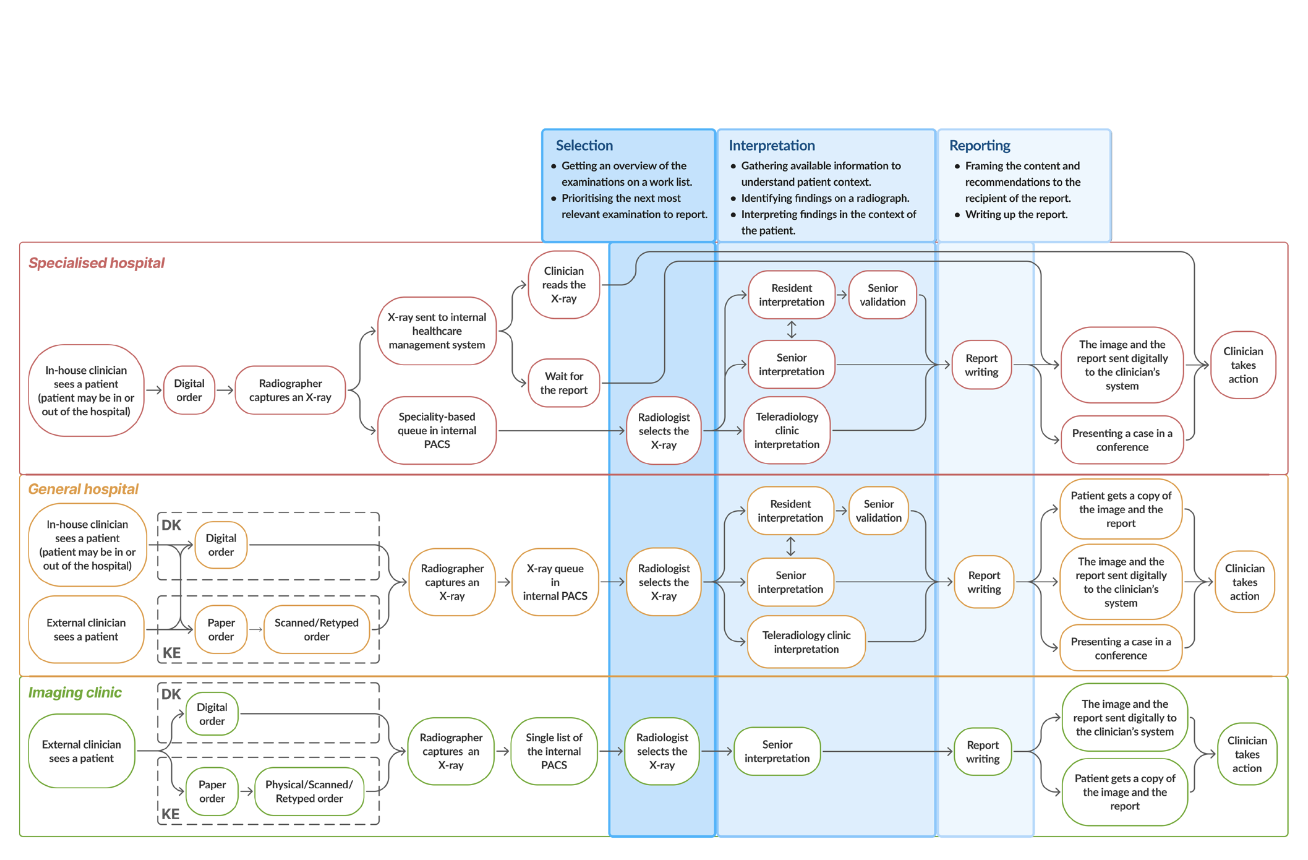 Схема работы отделения радиологии в разных типах клиник
Схема работы отделения радиологии в разных типах клиник
Реальные процессы работы отделения радиологии достаточно сложны. К примеру, рентген-лаборант, лечащий врач или даже сотрудник ресепшна могут попросить врача побыстрее посмотреть тот или иной снимок. Причём это может происходить как официально через пометку в PACS, так и по звонку или устной просьбе. Чаще всего в кабинете сидят несколько врачей, и они могут консультироваться друг у друга и обсуждать сложные случаи. Короче, идея в том, что ИИ-системы должны ложиться не на выдуманные, а на реальные процессы работы отделения (которые, кстати, оказались очень похожими в Дании и Кении).
Авторы выделили три основных этапа работы рентгенолога.
На этом выбора исследований есть две основных проблемы:
- Иногда количество исследований за день превышает доступное время врачей. В этих случаях можно использовать ИИ для маршрутизации исследований - например, отправлять кейсы без патологии более младшим врачам. Отмечается, что постоянно использовать такую систему нежелательно, чтоб не тормозить процесс обучения менее опытных врачей.
- Нет чёткой системы выбора следующего исследования для описания. Здесь можно настроить процесс так, чтобы приоритизировать реально срочные кейсы, где время имеет значение - к примеру, случаи, где ИИ обнаружил пневомотракс.
При интерпретации исследований ИИ может помогать иначе:
- Интерпретация визуально сложных или двояких случаев - не всегда есть возможность посоветоваться с коллегой, в этом случае таким коллегой становится ИИ-система. Ещё ИИ помогает не пропустить плохо видные находки - особенно в дни повышенной нагрузки.
- У врачей может много времени собирать сбор клинического контекста - к примеру, сравнение с архивными исследованиями. ИИ может быстро проанализировать все исследования в динамике и измерить размеры находок на всех исследованиях.
Наконец, при написании отчётов система может проверять, что врач не забыл отразить в отчёте все релевантные находки. К примеру, врач отмечает, что согласен с находками модели или редактирует их, а отдельная языковая модель потом проверяет, что содержание отчёта соответствует этим находкам.
Среди выводов есть один особенно интересный - ИИ-системы должны иметь возможность настройки под особенности места, где оно используется:
- Тип клиники - польза ИИ может быть совсем разной в университетской клинике, районной больнице и онкоцентре. Например, для специализированных учреждений может быть полезна функция маршрутизации в зависимости от типа находок, а для небольшой больницы - функция второго мнения.
- Экспертиза врача - опытный врач может запрашивать результаты ИИ-разработки только в особых случаях, а в остальных мозолить глаза ему/ей не нужно. А для молодых врачей можно автоматически подключать опытного коллегу для исследований, которые ИИ посчитает сложными. Можно даже выводить частичные результаты обработки рентген-лаборантам в экстренных случаях.
- Контекст - в конце дня врач может попросить ИИ подсветить 2-3 срочных случая, чтобы успеть их описать. Или в зависимости от того, откуда поступил пациент, можно подсвечивать в рабочем списке только определённые патологии.
Выводы
Как мы видим, европейские кейсы в основном описывают децентрализованное внедрение ИИ - на уровне конкретной больницы или сети клиник. Какие у этого есть плюсы?
- ИИ внедряется более вдумчиво - под боли и задачи конкретной организации. При централизованном подходе мы шагаем по стране, но особо нет времени и ресурса задумываться о том, какой сценарии будет полезен в той или иной больнице - и будет ли вообще.
- Больше гибкости - можно дообучать модели на данных организации и настраивать систему под каждого клиента. При централизации ИИ-вендор часто даже не имеет возможности пообщаться с конечным клиентом и пользователями.
- У организации больше мотивации активнее участвовать в процессе и менять свои процессы под эффективное использование ИИ-систем, потому что они сами являются активными участниками процесса, а не пассивными получателями услуги/технологии.
- Врачи подготовлены к использованию инструмента и часто сами являются инициаторами в отличие от случаев, когда внедрение происходит “из-под палки”.
- Проще оценить реальный экономический эффект для медицинской организации.
Что по преимуществам централизованного внедрения сверху-вниз на уровне страны или региона (как в России)?
- ИИ активно внедряется, даже если экономический эффект от внедрения априори не ясен или качество самих моделей ещё не достигло нужного уровня. Это сильно помогает ИИ-стартапам дожить до точки, где их продукты реально приносят пользу, а по пути получить кучу фидбека.
- При таком внедрении регулятор может находить способы обходить некоторые юридические барьеры - например, позволять проводить некоторые обновления без обновления сертификации (как в Эксперименте).
- Легче сделать прозрачную конкуренцию с рейтингами метрик и надёжности - а это побуждает производителей постоянно улучшать свои системы. В шведской статье упоминалось про кейсы, где клиника в итоге получала устаревшую версии модели, а обновление - за отдельные денежки.
- На уровне клиники не нужно создавать свои интеграционные костыли или пилить целую ИИ-платформу. У большинства клиник даже нет необходимых для этого ресурсов и компетенций.
- Удобства для ИИ-вендора - доступ к потоку исследований по всей стране (за июль только по флюорографии и рентгену лёгких мы обработали около 300к исследований со всей страны), можно держать одну инфраструктуру под всех заказчиков, меньше юридических и проектных затрат. Интеграция с каждым отдельным заказчиком требует определённых затрат, причём нередко значительных.
- Можно создать единые требования к качеству, а ещё удобно производить послерегистрационный мониторинг качества работы ИИ-систем - ведь всё обрабатывается в рамках одной платформы.
- Меньше неравенства - больница в дагестанском селе получает те же ИИ-сервисы, что богатая клиника в Москве.
Конечно, российский опыт мне знаком сильно лучше и изнутри, но могу точно сказать, где мы впереди:
- Проникновение ИИ - в первую очередь благодаря платформе МосМедИИ.
- Методологическая база - благодаря работе коллектива Московского Эксперимента.
- Прозрачность и конкурентность - благодаря публикации лидербордов и рейтингов клинической оценки.
И, как мне кажется, как обратная сторона скорости и массовости - немного пока отстаём в осмысленности внедрения и вовлечении медицинских организаций в процесс.
Так или иначе, каждый подход имеет право на жизнь - возможно, идеальным здесь был бы некий гибрид. Например, основные массовые направления закрываются федеральной платформой, а более узкие и специализированные кейсы разрабатываются и внедряются как отдельные экономически обоснованные проекты. К сожалению, по второму сценарию потенциальных партнёров и покупателей пока не так много.